胶质母细胞瘤 (GBM) 是一种毁灭性的恶性脑肿瘤,通常标准治疗包括外科手术、化疗和放疗,但中位生存期不到 2 年。免疫疗法是继手术,化疗和放疗之后的第四种抗癌治疗方式,在许多癌症类型中显示出希望,但在治疗脑肿瘤方面却没有类似的成功。CAR-T细胞疗法已经证明其在CD19阳性血癌以及淋巴瘤中拥有积极的效果,但同样在脑肿瘤方面具备风险,会出现细胞因子风暴,肺毒性和水肿,导致多器官功能障碍等副作用。因此需要采取创新措施,使免疫疗法对脑肿瘤更有效。近日,日本东京大学和名古屋大学的研究人员在《Molecular Therapy: Oncolytics》 期刊上发表了题为:Efficacy of cancer-specific anti-podoplanin CAR-T cells and oncolytic herpes virus G47Δ combination therapy against glioblastoma 的研究论文,首次证明了CAR-T细胞和溶瘤病毒的联合疗法可以阻止胶质母细胞瘤(GBM)的生长并显著提升小鼠存活率,这为免疫联合疗法治疗实体肿瘤提供了新的见解。研究人员设计了一种以针对PDPN位点的癌症特异性单克隆抗体Lp2为基础构建了新型CAR-T细胞(Lp2-CAR-T细胞),Lp2不会识别表达PDPN的正常细胞,从而有望增强CAR-T疗法对癌细胞的特异性识别能力。体外实验表明这种新CAR-T细胞可以有效溶解LN229/hPDPN细胞(表达PDPN的GBM细胞),而对PDPN阴性的LN229细胞和Met-5A细胞不产生显著影响。此外,将Lp2-CAR-T细胞与LN229/hPDPN细胞共培养,可以在上清液中检测到100.1pg/ml的干扰素-γ(IFN-γ),这比模拟CAR-T细胞(Mock-CAR-T cell)高出十倍以上。他们还观察到Lp2-CAR-T细胞对患者来源的胶质瘤干细胞TGS01也具有溶解作用。与此同时,与溶瘤病毒联合疗法试验也展现出积极的一面,溶瘤病毒不仅能直接杀死实体肿瘤,还能引起抗肿瘤免疫反应,破坏肿瘤微环境中的免疫抑制成分,促进CAR-T细胞对实体瘤的浸润。他们在小鼠体内注射CAR-T细胞和溶瘤病毒G47Δ,并持续监测小鼠肿瘤大小和存活情况。结果显示:联合疗法的小鼠其肿瘤大小不到单独疗法肿瘤大小的一半,显示出最佳的肿瘤抑制作用。并且联合疗法治疗的小鼠,其40天存活率提高了5倍以上,半数小鼠存活达到60天以上。
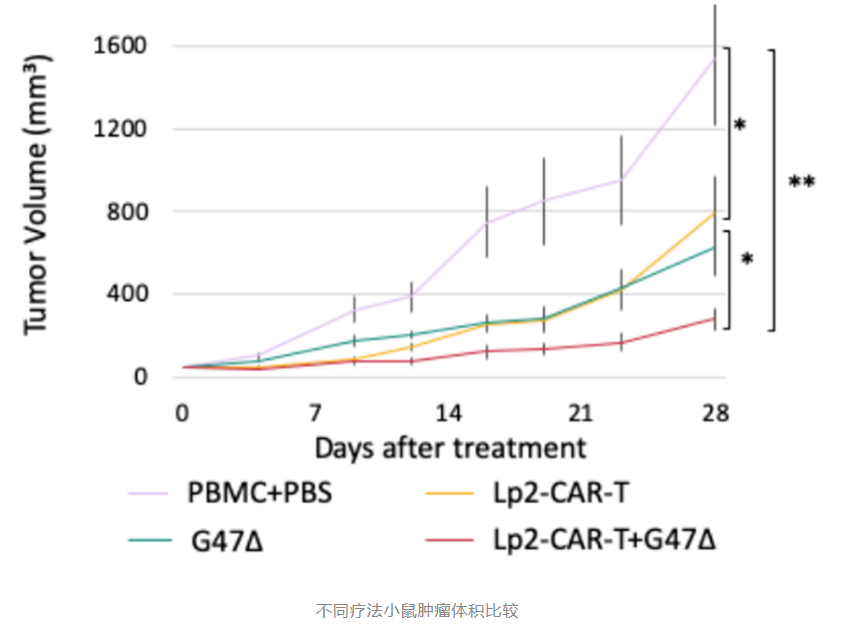
值得一提的是,在安全性方面,无一小鼠观察到不良反应。证明其安全性以及副作用可控,风险较低。
这些实验结果表明,CAR-T细胞和溶瘤病毒的联合疗法可以阻止人源胶质母细胞瘤(GBM)的生长并显著提升小鼠存活率,有望为CAR-T的实体瘤治疗困境提供新的突破口。
1.https://www.cell.com/molecular-therapy-family/oncolytics/fulltext/S2372-7705(22)00095-X?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS237277052200095X%3Fshowall%3Dtrue