因为CAR-T在实体瘤上鲜有实质性进展,TIL疗法因在克服细胞疗法在实体瘤领域某些障碍上的某些天然优势而被寄于了很高的期望。对于今年有望首款TIL疗法的获批,行业呼声不断。
但是,在监管方不断的迟疑中,TIL疗法今年上市的希望又破灭了。近日(2022年11月20日),FDA再次推迟了Iovance TIL疗法Lifileucel的上市进程,至2023年。
Lifileucel是一种肿瘤浸润淋巴细胞(TIL)疗法,属于过继性免疫治疗的一种。Lifileucel首先从患者体内提取TIL,并通过IL-2刺激在体外培养中对其进行十亿数量级的扩增。扩增过程还可以消除肿瘤微环境的免疫抑制效果,同样的培养环境也可以优化侵略性抗肿瘤TIL的复制和激活。当培养出足够数量的具有抗肿瘤潜力的细胞后,这些细胞再次回输到患者体内。
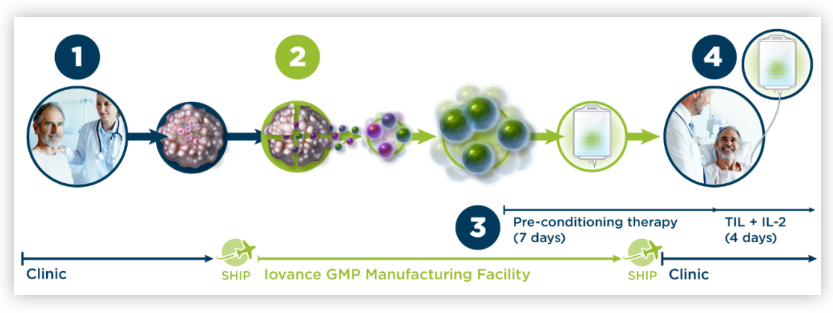
从Iovance披露的临床数据来看,lifileucel作为一种个性化细胞疗法在实体瘤还是令人鼓舞。据此前披露的临床数据显示,Lifileucel对于PD-1抗体抵抗的黑色素瘤患者仍然有36%的总缓解率(ORR);对于PD-1抗体抵抗的非小细胞肺癌患者,TIL疗法仍可达到21%的ORR。这种在PD-1治疗后仍能令晚期患者达到持久缓解甚至是完全缓解的能力令人鼓舞。
Lifileucel的上市申请(BLA)提交得到了关键临床研究C-144-01临床试验的支持。相关阅读:一波三折!首款TIL疗法递交滚动上市申请
而对于这种高度个性化细胞疗法,从lifileucel三次被拦截,上市进程屡屡延期,可看出监管方保持非常谨慎的态度。2020年10月,lifileucel首次遭到FDA拦截。在FDA召开的B型讨论会上,Iovance未能就全面定义Lifileucel所需的效力分析与FDA达成一致,上市申请计划因此推迟到2021年。2021年5月19日,lifileucel的上市进程第二次被FDA拦截,FDA表示希望获得更多关于lifileucel效力分析的数据,lifileucel上市申请计划再次被推迟至2022年。直到今年4月,Iovance提出了对于Lifileucel的效力测定矩阵,并收到了来自FDA的积极反馈。今年8月份,Iovance终于向FDA滚动提交了Lifleucel的上市申请。不过,这次FDA对“补充活性和可比性数据”又提出了新问题,而为了消除这些质疑,公司预计要到2023年第一季度才能完成备案。与CAR-T疗法一样,TIL作为一种高度个性化的细胞疗法,同样面临可及性方面方面的问题。TIL的治疗响应受到肿瘤浸润T细胞的初始数量、TME中免疫抑制细胞类型的存在以及过继转移中扩增障碍等许多因素的限制。之前一家名为Instil Bio公司因为一些生产问题,暂停了其两款候选TIL疗法ITIL-168和ITIL-306的临床入组。公司计划在采取纠正措施提高了生产成功率后,再启临床。TIL疗法经过数十年的发展,终于走到了台前。在黑色素瘤、宫颈癌等实体瘤适应症中体现了其抗癌的高效性与安全性,甚至展现了与CAR-T疗法相似的临床治愈潜力。不过,作为一种高度个性化细胞疗法,TIL疗法在细胞来源、扩增方法等生产方面仍待优化和提升。1.https://endpts.com/fda-hits-iovance-with-one-more-delay-for-til-therapy-extending-bla-filing-until-2023/2.https://www.zhitongcaijing.com/content/detail/834078.html
3.实体瘤细胞治疗40年磨一剑:首款TIL疗法待发