6月27日,和铂医药宣布,其在研产品B7H4x4-1BB双特异性抗体(HBM7008)获得美国食品药品监督管理局(FDA)临床试验申请(IND)许可。HBM7008于上月在澳大利亚完成I期临床试验的首例患者给药,并于本月初获得中国药品监督管理局(NMPA)临床试验批准。
和铂医药首席医学官Humphrey Gardner医生表示:“作为全球首创针对B7H4及4-1BB的双特异性抗体,HBM7008有望引领下一代肿瘤免疫疗法的发展。随着美国临床试验申请获得许可,我们将加快推进该项产品的全球多中心I期临床研究。”
HBM7008是一种针对肿瘤相关抗原B7H4x4-1BB的双特异性抗体,由和铂医药创新的免疫细胞衔接器HBICE®平台开发,同时靶向肿瘤抗原B7H4和T细胞共刺激分子4-1BB的创新双特异性抗体,其仅在与B7H4结合时,特异性激活T细胞,产生抗肿瘤活性。
由于其高度依赖以肿瘤相关抗原为介导,与T细胞活化进行交叉链接,因此在T细胞共刺激及抑制肿瘤生长方面的功效显著,同时提高安全性,减轻了第一代4-1BB激动剂引发的肝脏毒性等毒副作用。
HBM7008是目前全球针对这两个靶点的唯一双特异性抗体。其独特的肿瘤表达特异性和免疫调控活性,有望在PD-L1阴性或对PD-1/PD-L1免疫治疗药物具耐药性的患者中,产生更好的疗效。
B7H4是PD-L1的同家族蛋白,在肿瘤免疫逃逸中起到类似的免疫检查点功能,同时也是肿瘤上高表达的肿瘤相关抗原。B7H4在病人中的表达与PD-L1的表达互补,因此很可能是PD-L1的一个补偿通路,有望在PD-L1低表达或者PD-L1疗法耐药的病人中起到抑制免疫抗肿瘤的功能。
不过靶向B7H4的单抗疗效不佳,其作为补偿通路起不到和PD-L1相当的主导作用,在此基础上研发的B7H4x4-1BB双抗,进一步通过激活4-1BB信号介导的T效应细胞,增强了针对B7H4高表达病人的抗肿瘤免疫。
B7H4在多种恶性实体瘤中有过度表达,包括乳腺癌、非小细胞肺癌、卵巢癌及子宫内膜癌。
和铂医药HCAb平台能够产生高度多样化和稳定的全人源重链抗体及其衍生的全人源单域抗体,可以实现用更小的分子量和更少的蛋白多肽链的简单机构去构建新颖的多特异性抗体。HBICE® 就是基于HCAb的免疫细胞衔接器平台。
HBICE®分子可以同时特异性地识别肿瘤细胞上的肿瘤相关抗原和免疫细胞(例如T细胞或NK细胞)上的CD3分子或者其他共刺激分子。HBICE®分子将免疫细胞和肿瘤细胞拉近在一起,从而高效地有选择性地激活肿瘤微环境中的免疫细胞,并防止了外周免疫细胞的非特异性活化。
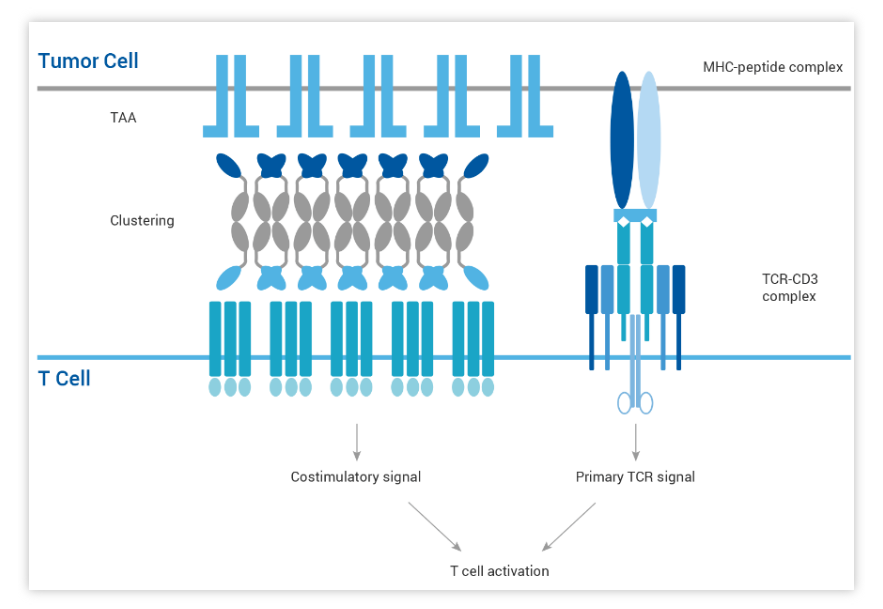
HBICE®分子可以通过不同的途径来激活免疫细胞。一方面,靶向CD3的HBICE®分子以非MHC限制的方式来激活T细胞,进而克服因肿瘤细胞MHC下调或抗原递呈细胞耐受引起的免疫逃逸机制。另一方面,靶向共刺激分子的HBICE®分子可引起肿瘤相关抗原介导的共刺激分子的交联以及下游信号传导通路的激活,为T细胞的完全激活提供了共刺激信号,进而充分活化T细胞,提高其杀伤肿瘤的效力。
B7H4在病人中的表达与PD-L1的表达互补,未来可以用于PD-L1低表达或者PD-L1疗法耐药的病人,对于B7H4单抗疗效不佳的问题,和铂医药全球首创的B7H4x4-1BB双抗或许能够解决,如果能够成功获批上市,那么将提供双抗解决单抗问题的新思路。