对曲妥珠单抗或T-DM1的耐药性机制已经有广泛研究,目前还很少有针对T-DXd耐药的研究,但部分曲妥珠单抗和/或T-DM1机制可以外推到T-DXd。对于HER2阳性乳腺癌患者,一线治疗通常选用选曲妥珠单抗(T)、帕妥珠单抗(P)双靶向治疗联合紫杉类药物。对于一线治疗失败的患者,使用HER2-ADC药物作为二线用药。已有的一些临床研究(如SePHER study)显示,一线曲妥珠单抗(T)、帕妥珠单抗(P)双靶向会下调HER2表达,且可以介导对二线HER2-ADC耐药。

除了上述表达下调或缺失,如果患者表达截断型HER2(p95HER2),对于HER2抗体类药物(含HER2-ADC)的响应明显下降。

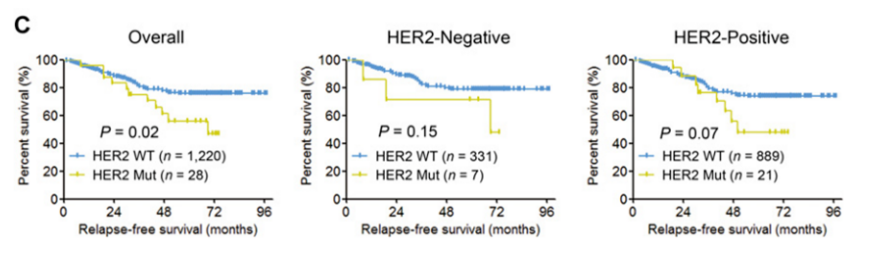
复旦大学肿瘤医院邵志敏教授在Clinical Cancer Research发表的结果显示,HER2的体细胞突变率为2.24%(28/1248),如果HER2阳性肿瘤患者发生激酶结构域突变则对HER2靶向治疗产生耐受,患者预后差。
HER2-ADC结合HER2后,被内化进入核内体,是其发挥生物学效应的重要一步,Endothilin A2 (Endo II)可以促进这一过程。体外试验,敲除Endo II可以降低肿瘤细胞对于T-DM1的敏感性。

包含HER2的核内体如果向质膜再循环过快,则减少T-DM1到达溶酶体的数量,从而降低T-DM1等ADC的疗效。相关的研究显示,这种耐药发生在不可切割linker的ADC,如果是可切割linker的ADC不受此影响。所以在这一条机制上,T-Dxd不同于T-DM1。HER2-ADC到达溶酶体,并被溶酶体酶的处理,释放与抗体结合的有效载荷是必不可少步骤。溶酶体环境是酸性,它们的蛋白水解能力依赖于调节溶酶体pH的质子泵H+-ATPase(V-ATPase)。由于溶酶体膜不渗透带电的分解代谢物,Lys-MCC-DM1需要从溶酶体到细胞质的转运。溶酶体pH的增加,以及溶酶体酶活性降低,V-ATP酶的异常活性降低,是对T-DM1 产生耐药性的原因。
SLC46A3是一种溶酶体膜蛋白,介导Lys-MCC-DM1从溶酶体到细胞质的转运。SLC46A3表达的缺失,可能也是耐药的一个机制。外排泵表达和/或活性增加,已成为化疗耐药重要机制。关于T-DM1,ATP结合(ABC)转运体可以将化合物Lys-MCC-DM1喷射到细胞外,阻止其与微管蛋白结合。体外实验,抑制转运体活性可恢复肿瘤细胞对T-DM1的敏感性。体外研究,加入HER3的配体NRG1可以促进HER2/HER3的二聚化,并激活PI3K-AKT途径,可以降低肿瘤细胞对T-DM1的敏感性。T-DM1治疗,可以增加HER3和NRG1的表达。
T-DM1治疗可以减少HER2表达,但会增加EGFR的表达,EGFR表达增加,会增加integrins (α5β1 and αVβ3),促进耐药肿瘤细胞的运动和转移。对T-DM1敏感的HER2+乳腺癌细胞系中,使用ADC治疗导致细胞cyclinB1增加,并在细胞周期的G2/M期停止。然而,在对T-DM1耐药的细胞中没有观察到这种现象,因为细胞cyclinB1没有发生积累。在该研究中,亲本细胞系中cyclinB1的沉默产生了对T-DM1的抗性,而增加cyclinB1部分地使抗性细胞系致敏。与亲本细胞系相比,在对T-DM1耐药的模型中观察到有丝分裂激酶PLK1的表达增加。在临床前模型中,在基因组和药理水平上抑制PLK1,逆转对T-DM1的耐药性。T-DM1治疗会引起PTEN的丢失和编码PI3K催化亚基(PIK3CA)基因的激活突变导致PI3K/AKT通路的结构性激活,产生耐药。
参考资料
Bon, G.; Pizzuti, L.; Laquintana, V.; Loria, R.; Porru, M.; Marchiò, C.; Krasniqi, E.; Barba, M.; Maugeri-Saccà, M.; Gamucci, T.; et al. Loss of HER2 and decreased T-DM1 efficacy in HER2 positive advanced breast cancer treated with dual HER2 blockade: The SePHER Study. J. Exp. Clin. Cancer Res. 2020, 39, 279
Scaltriti, M.; Rojo, F.; Ocaña, A.; Anido, J.; Guzman, M.; Cortes, J.; Di Cosimo, S.; Matias-Guiu, X.; Ramon y Cajal, S.; Arribas, J.; et al. Expression of p95HER2, a truncated form of the HER2 receptor, and response to anti-HER2 therapies in breast cancer. J. Natl. Cancer Inst. 2007, 99, 628–638
Zuo, W.-J.; Jiang, Y.-Z.; Wang, Y.-J.; Xu, X.-E.; Hu, X.; Liu, G.-Y.; Wu, J.; Di, G.-H.; Yu, K.-D.; Shao, Z.-M. Dual Characteristics of Novel HER2 Kinase Domain Mutations in Response to HER2-Targeted Therapies in Human Breast Cancer. Clin. Cancer Res. 2016, 22, 4859–4869
Loganzo, F.; Tan, X.; Sung, M.; Jin, G.; Myers, J.S.; Melamud, E.; Wang, F.; Diesl, V.; Follettie, M.T.; Musto, S. Tumor cells chronically treated with a trastuzumab–maytansinoid antibody-drug conjugate develop varied resistance mechanisms but respond to alternate treatments. Mol. Cancer Ther. 2015, 14, 952–963.
Schwarz, L.J.; Hutchinson, K.E.; Rexer, B.N.; Estrada, M.V.; Gonzalez Ericsson, P.I.; Sanders, M.E.; Dugger, T.C.; Formisano, L.; Guerrero-Zotano, A.; Red-Brewer, M. An ERBB1-3 neutralizing antibody mixture with high activity against drug-resistant HER2+ breast cancers with ERBB ligand overexpression. J. Natl. Cancer Inst. 2017, 109, djx065
Li, G.; Guo, J.; Shen, B.Q.; Yadav, D.B.; Sliwkowski, M.X.; Crocker, L.M.; Lacap, J.A.; Phillips, G.D.L. Mechanisms of Acquired Resistance to Trastuzumab Emtansine in Breast Cancer Cells. Mol. Cancer Ther. 2018, 17, 1441–1453