7月28日Biogen在著名期刊《新英格兰医学杂志》上发表了关于治疗皮肤红斑狼疮BDCA2靶向抗体药物Litifilimab (BIIB059)的阳性II期数据。II期临床LILAC研究表明,安慰剂相比,达到了主要终点,litifilimab显著降低了皮肤红斑狼疮(CLE)患者的皮肤病活动性。

Biogen方面表明,目前已将litifilimab进展到晚期开发阶段,并正在积极招募系统性红斑狼疮参与者参加3期TOPAZ-1和TOPAZ-2研究,并计划于今年晚些时候在CLE启动一项关键研究。红斑狼疮的治疗目前以糖皮质激素、免疫抑制剂、抗疟药为主。其中仅部分有效,并且具有广泛的毒性。考虑到系统性红斑狼疮容易引起一系列多系统损害甚至导致器官衰竭,对中度患者来说,不及时治疗可能危及生命,而在药物安全性和有效性方面,这一领域仍然存在未曾满足的需求,开发一款安全有效的红斑狼疮药物相当重要。从机理机制方面来看,I型IFN如IFN-α、IFN-β和IFN-κ是参与调节SLE炎症通路的细胞因子,60%~80%的系统性红斑狼疮患者存在I型干扰素高表达特征,而且I型干扰素浓度与系统性红斑狼疮患者疾病活动指数(SLEDAI)评分呈正相关。因此I型IFN靶点拮抗剂是SLE的可能治疗手段之一,例如阿斯利康已经获得批准的Saphnelo(anifrolumab-fnia)。此外,通过其他通路间接抑制I型IFN也是一种可行的方法。浆细胞样树突状细胞(pDCs)是一种特殊的骨髓衍生细胞群,浆细胞样dc (pDCs)是一种特殊的骨髓源性细胞,在与内体TLR7或TLR9结合的配体作用下合成大量IFN-I。pDCs也被认为是免疫复合物中IFN-I的主要来源。在CLE中,pDCs在皮损中积累并产生IFN- i和IFN-λ(如下图大箭头所示),这是通过表皮中IFN反应蛋白MxA的上调检测到的。pDCs还分泌广泛的细胞因子和趋化因子,除IFN-I外,这些细胞因子和趋化因子可能支持炎症细胞进入病变。
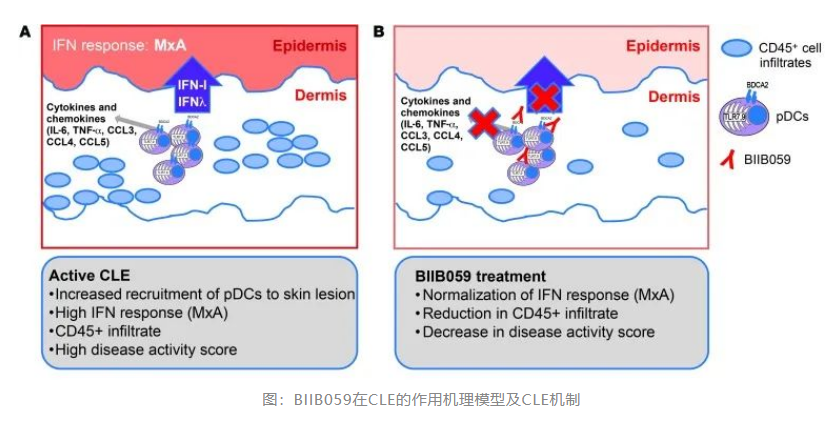
在SLE中,pDC数量在血液中减少,并在受影响的器官中积聚,如损伤性皮肤或肾脏。考虑到pDCs在皮肤病变或肾脏中的积聚,以及它们产生大量IFN-I的能力,使pDCs成为SLE治疗干预的有吸引力的靶点。在TLR7/TLR9依赖性皮肤疾病以及狼疮性肾炎的临床前小鼠模型中,已经显示出pDCs的去除是有益的,这进一步支持了pDCs的致病潜力。Litifilimab(BIIB059)则是首个专门针对SLE患者pDCs的疗法,是一种人源化IgG1单抗,能够特异性识别人类pDCs表面唯一表达的血液DC抗原2 (BDCA2)。BIIB059与BDCA2结合导致其从人类pDCs的细胞表面快速内化(如上图所示),导致IFN-反应蛋白MxA抑制,并随后抑制IFN-I(所有亚型)、细胞因子和pDCs产生的趋化因子。从Biogen今年第二季度财报给出的成绩来看,Biogen显然没能给出优异的答卷。多发性硬化症药物的激烈市场竞争及专利纠纷,阿尔兹海默症药物ADUHELM的余波以及Zolgensma对于SPINRAZA强有力竞争三项合力仍旧冲击着Biogen的地位。同比2021年同期不进反退,Biogen这个时候必须要一款拳头产品撑起这片天,而红斑狼疮市场似乎对于Biogen来说是可行的。
世界范围内对SLE患病人数的估计有很大差异,并且受种族和地理差异以及研究设计的影响。大量证据表明,在亚裔和非裔美国人中,SLE的发病率更高,病程更严重,造成更多的器官损害,死亡率也更高。预计2022年全球SLE患病人数将达800万人。而我国SLE患者2022年预期将达到105万人。考虑到今年2月litifilimab已经在我国获批临床,Biogen可能将SLE的市场中心转移到我国。https://investors.biogen.com/news-releases/news-release-details/new-england-journal-medicine-publishes-positive-phase-2-datahttps://investors.biogen.com/static-files/724ad1b4-ec92-4899-80ab-ef11f81c1bbd