近日(2022年3月24日),根据中国国家药品监督管理局药品审评中心(CDE)网站最新公示,西比曼生物旗下赛比曼生物的抗CD19/CD20嵌合抗原受体自体T细胞注射液的临床申请获得NMPA的受理。
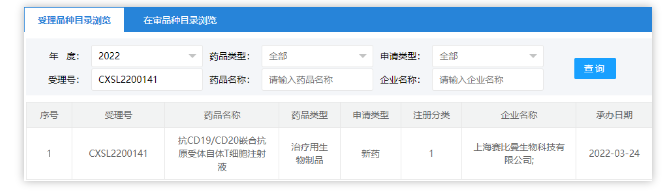
上海赛比曼生物为西比曼生物旗下的子公司,今天受理的该款双靶点CAR-T应该为西比曼代号为C-CAR039的一款候选产品。此前已获得FDA孤儿药资格认定,用于治疗滤泡性淋巴瘤。C-CAR039是一种新型第二代4-1BB双靶点CAR-T,具有经优化的双特异性抗原结合结构域,可同时作用于CD19和CD20两个靶点,同时在体内和体外清除CD19/CD20单阳性或双阳性肿瘤细胞。据公司称,C-CAR039的GMP生产是在无血清且完全封闭的半自动系统中进行的。2021年6月,西比曼生物在ASCO 2021年会上公布了C-CAR039治疗复发或难治性B细胞非霍奇金淋巴瘤(B-NHL)的最新临床数据,数据显示,C-CAR039实现了92.6%的最佳总缓解率,完全缓解(CR)率达85.2%。目前FDA已累计批准6款CAR-T细胞疗法上市,NMPA批准2款CAR-T细胞疗法上市。这些单靶点CAR-T疗法在血液肿瘤的治疗中已取得了非凡的疗效,但临床长期随访显示,诸多接受CAR-T治疗后实现完全缓解的患者仍然出现了疾病进展或复发,而在这些复发的人群中发现,有相当高比例的患者会出现靶抗原丢失或调节,进而导致靶标阴性的肿瘤细胞大量增殖,使得CAR-T治疗失效。
基于此,通过开发靶向两种不同肿瘤抗原的双靶点CAR-T被视为降低肿瘤复发风险,阻止抗原逃逸的一种策略,目前诸如CD19/CD20、CD19/CD22等联合双靶点的CAR-T技术正在被一批企业开发。

恒润达生为国内首家提交临床申请的双靶点CAR-T产品公司。2020年10月20日,恒润达生的双靶点CAR-T细胞产品抗人CD19-CD22 T细胞注射液的临床申请获得受理。2021年1月7日获批临床。上周,NMPA还批准国内首个通用的双靶点CAR-T。推荐阅读:国内首家!CD19/CD22 “现货”CAR-T细胞获批临床1.https://www.cellbiomedgroup.com/