HEK293细胞,又名人胚胎肾细胞293,是一个衍生自人胚胎肾细胞的细胞系。因其对培养环境要求不高、易于转染等特点,被广泛用于治疗性蛋白生产、疫苗中的病毒样颗粒生产、细胞和基因治疗中的病毒包装或用于开展相关的科学研究。但也有实验证明,HEK293注射入裸鼠中可成瘤,所以HEK293细胞的残留成分是生物制品质量控制中一个重要环节,需要被控制在可接受的水平。
因为外源宿主细胞DNA会引发潜在的安全问题(如潜在致瘤性、传染性,甚至增加免疫源性或导致突变),所以相关的法律法规相继出台以对生物制品中外源宿主DNA残留量进行严格把控。WHO和美国FDA现行指导方针推荐成品中残留DNA不高于10 ng/剂,美国FDA还指出生物制品宿主细胞DNA残留DNA不高于100 pg/剂。欧洲药典通则规定生物制品残留DNA限度大多为不超过10 ng/剂,但对个别疫苗的残留DNA限定标准更严格,如甲型肝炎灭活疫苗中的DNA残留量不得超过100 pg/剂,乙型肝炎疫苗中的DNA残留量不得超过10 pg/剂。中国药典2020年版三部规定,以细胞基质生产的生物制剂外源宿主细胞DNA残留量不能超过100 pg/剂,以细菌或真菌基质生产的疫苗DNA残留量不能超过10 ng/剂。
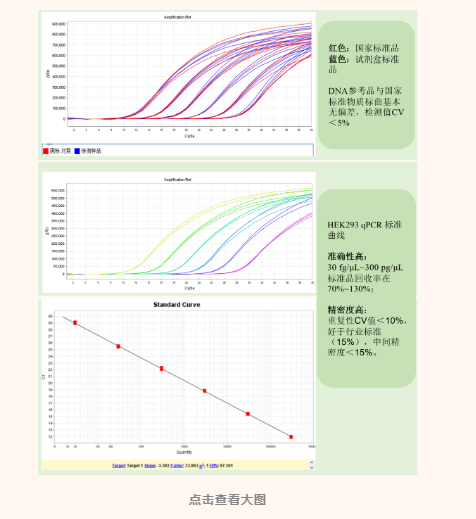
由此可见,建立合适的外源宿主DNA残留量检测方法有助于帮助企业优化下游纯化工艺,在GMP规范下进行纯化中间过程和终产品质量控制,确保原液和成品的安全性和稳定性。相较于2015版中国药典,2020版药典通则<3407>中将定量PCR法作为外源性DNA残留量测定的第3种方法。与前2种传统方法即DNA探针杂交法和荧光染色法相比,定量PCR法的技术优势在于序列特异性高、灵敏度高、重现性好、通量高、耗时短等。翌圣生物基于定量PCR法,研发了具有自主知识产权的HEK293宿主细胞DNA残留量检测试剂盒(产品编号:41302ES50/60),该试剂盒能够专一快速的对中控样品或原液成品中HEK293宿主细胞DNA进行准确定量,定量下限达到6 fg/μL,满足工业客户的工艺研究和质控需求。41302ES试剂盒采用Taqman荧光探针法,利用特异性的引物序列搭配通用的FAM/BHQ报告和淬灭基团,进行特异性的序列扩增。灵敏度高:能够准确定量低至6 fg/μL的HEK293细胞DNA;
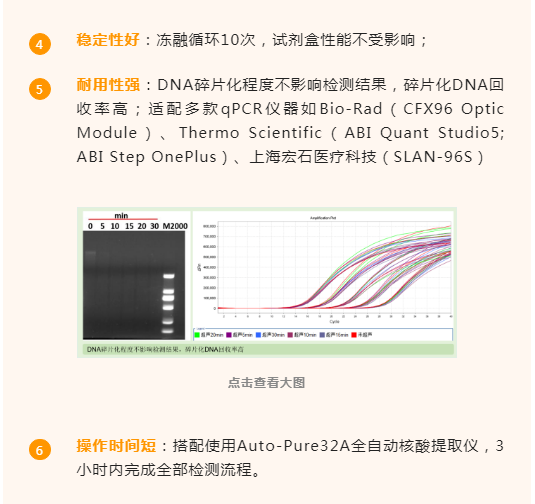
特异性强:具有HEK293 DNA特异性,与无关DNA不存在交叉反应;