从癌症基因测序开始,到癌症免疫治疗的不断进步。几十年内,各种各样的致癌基因被鉴定出,例如EGFR,ALK,NTRK,MET等等。这使得癌症学家研发出一代又一代的靶向药物用于治疗,使癌症患者选择面更多,生存期更长,治疗效果更好。然而,作为癌症中最常出现的突变基因KRAS,从发现到现在已经三十多年,却难以攻破其靶向药物。不过在近期,越来越多运用了不同技术来针对KRAS突变的药物被开发出来,最快的均已进入临床试验阶段。
KRAS是RAS家族中最常出现的亚型,KRAS基因突变占RAS基因突变总数的85%(NRAS(12%)次之,HRAS(3%)最少)。RAS在许多重要细胞信号网络的轴上处于中心位置,因此它们与许多癌症标志有关。RAS是人类癌症中最常出现突变的致癌基因,目前已经在所有人类肿瘤的大约1/5中发现了突变引起的RAS蛋白激活。
在人类癌症中,KRAS基因突变出现在接近90%的胰腺癌中,30-40%的结肠癌中,17%的子宫内膜癌中,15-20%的肺癌中(大多为NSCLC)。它也会在胆管癌、宫颈癌、膀胱癌、肝癌和乳腺癌等癌症类型中出现。也就是说,在上述多种癌症中,有高比例的KRAS基因突变。
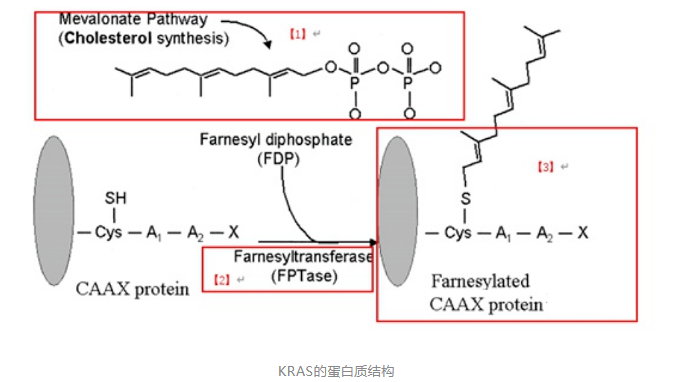
KRAS蛋白质有188个氨基酸,它的分子量是21.6KD。拥有GTPase酶活性的鸟嘌呤核苷结合蛋白。KRAS蛋白定位在细胞膜的内侧,通过一个Farnesyl的修饰基团,连到细胞膜上。在Farnesyl转移酶的作用下,加到KRAS蛋白上。
KRAS中最常见的突变为G12D、G12V、G13D,当发生这几种突变后,会通过破坏GAP活性,KRAS会一直保持与鸟嘌呤核苷三磷酸(GTP)结合,激活下游信号通路,促进细胞生存、增殖和细胞因子释放等方面。不断地激活下游通道最终会促进肿瘤的产生。
KRAS基因的突变,会直接影响到常规针对EGFR基因的抗肿瘤药物的疗效如西妥昔、易瑞沙等。会使得疗效下降,因为KRAS把药物对EGFR的抑制作用给绕开了。同时KRAS基因是否有突变,也是肿瘤预后的一个重要指标。
KRAS如此重要,为何现如今几乎没有针对KRAS的靶向基因药物?主要存在以下几个难点。
1. KRAS难以靶向结合。蛋白是一种无特征、近乎球形的结构,无明显结合位点,很难合成一种能靶向结合并抑制其活性的化合物。
2. KRAS的正常活性功能也是正常细胞所需的功能,且KRAS与NRAS、HRAS有很高的同源性,能抑制RAS活性的药物,就很可能会抑制NRAS、HRAS的活性。最终可能会使得KRAS药物副作用极大。
3. KRAS与GDP、或GTP结合的能力非常强,亲合系数达到PicoMolar(皮摩尔浓度,10^-12)级。常规药物很难达到KRAS与GDP、或GTP结合的能力。想要做出一种小分子化合物,并且能够与其结合能力相配,非常困难。而且细胞内正常的GDP与GTP的浓度,比与KRAS结合所需的浓度,高了10的6次方倍。
4. 间接靶向KRAS的方法通常包括阻断KRAS细胞膜定位和靶向KRAS下游的信号分子,如RAF、MEK、ERK和PI3K等。但其也存在困难,如补偿逃逸机制;由于严格调节导致的信号反馈和冗余;无法避免的毒副作用。
近日,著名医学期刊《新英格兰医学杂志》发表的一项研究显示,使用靶向癌细胞表达的KRAS G12D突变体的自体T细胞疗法,一名接受过多种前期治疗的患者获得深度并且持久的肿瘤缩小。《新英格兰医学杂志》专门为这项研究发表了两篇评论文章,著名学者Eric Topol也在推特上发文表示这是一项开创性(groundbreaking)研究。
在这项研究中,研究人员使用的是T细胞受体(TCR)细胞疗法。TCR能够识别被癌症细胞的HLA蛋白呈递在细胞表面的肿瘤抗原。在这项研究中,研究人员将胰腺癌患者的T细胞在体外进行基因工程改造,表达了两种不同的TCR,它们能够识别被HLA-C*08:02分子呈递的包含G12D突变的多肽。这两种TCR不但能够精准识别包含G12D突变的多肽,而且不会对野生型的KRAS产生反应,从而能够精准靶向携带KRAS G12D突变的胰腺癌细胞。
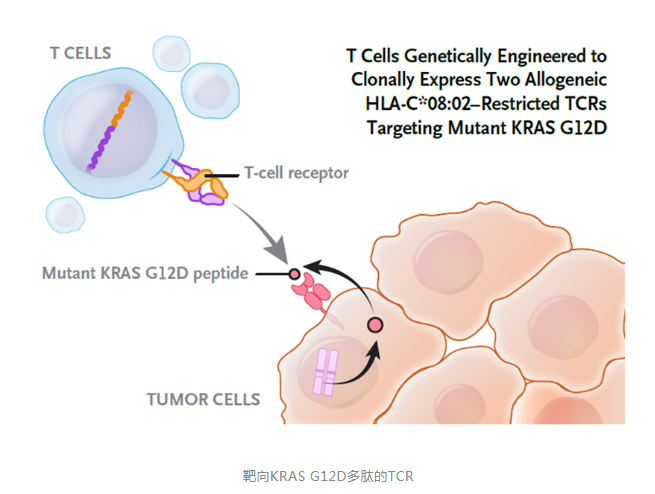
在接受TCR细胞疗法治疗后,患者获得部分缓解,内脏转移瘤体积缩小72%。在接受治疗6个月后,基因工程改造的T细胞占患者循环外周血T细胞的2%。患者的缓解在6个月时仍然得到维持。可见其治疗效果是非常成功的。
工程化T细胞受体(TCR)是近年来火热的过继性T细胞免疫疗法之一。TCR工程T细胞表达肿瘤抗原特异性受体,其α链和β链由高质量、高亲和力的抗原特异性T细胞克隆产生。
TCR分子属于免疫球蛋白的一个超家族,由两个共价结合的多态性亚单位组成,每个亚单位都是抗原特异性的,它们至少与四种不同类型的信号转导链有关。TCR为所有T细胞表面的特征性标志,以非共价键与CD3结合,形成TCR—CD3复合物。TCR的作用是能够识别抗原。
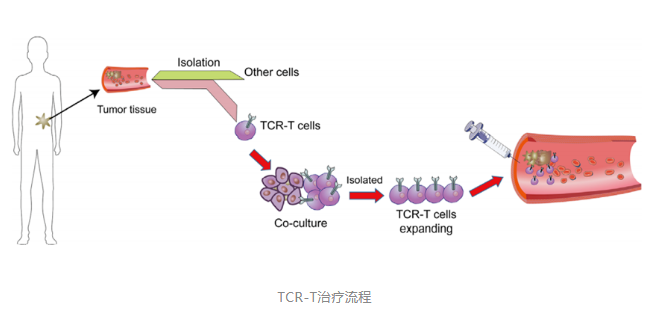
TCR因其特性较常用于TCR-T疗法。该技术通过筛选和鉴定能够特异性结合选择靶点抗原的TCR序列,利用基因工程手段将其转入到患者外周血来源的T细胞中(或异源T细胞) ,再将改造后的T细胞回输至患者体内,使其特异性识别和杀伤表达抗原的肿瘤细胞,从而达到治疗肿瘤的目的。
目前能够明确适应的实体瘤种类包括转移性非小细胞肺癌、肝细胞癌、多发性骨髓瘤、软组织肉瘤、头颈癌、黑色素瘤、脂肪肉瘤、宫颈癌等,适应症非常广。
除了TCR-T之外,CAR-T疗法也同样是时下热门。同样作为T细胞免疫疗法,TCR-T和CAR-T细胞都已被成功地用于实体瘤的临床治疗。但这两种方法效果上存在着什么的不同呢?
一是TCR-T疗法靶向实体瘤效果更明显。在实体瘤的疗法研究中,TCR-T疗法取得了优于CAR-T疗法的治疗效果。对比TCR-T细胞与CAR-T细胞对实体瘤的攻击效果可以发现,大部分TCR-T能与更多肿瘤细胞结合,药物分布更加均衡,而CAR-T通常会在肿瘤外层附着而不向内部渗透,有效率较低。
二是TCR-T细胞在人体内存留时间更长。这主要是由于TCR-T细胞本身就在人体内自然表达,完全人源化,所以不会引起机体的免疫排斥;同时,TCR-T细胞具有免疫记忆功能,可以在体内存活较长时间。而对于CAR-T而言,部分人为的基因改造会缩短CAR-T存活时间,影响治疗结果。此外,在未来发展方面,单细胞测序技术、噬菌体展示技术还将赋能TCR-T疗法进一步发展。
1.https://www.biospace.com/
1.Farnesyltransferaseinhibitorsinhematologicmalignancies:newhorizonsintherapy
2.https://linkinghub.elsevier.com/retrieve/pii/S2211383518309584
3.http://www.tumorsci.org/rhtml/m00001/2018/38/3/256.html
[4] Leidner at al., (2022). Neoantigen T-Cell Receptor Gene Therapyin Pancreatic Cancer. NEJM, DOI: 10.1056/NEJMoa2119662
[5]Eric Topol. Retrieved June 1, 2022, fromhttps://twitter.com/EricTopol/status/1532105835425411072