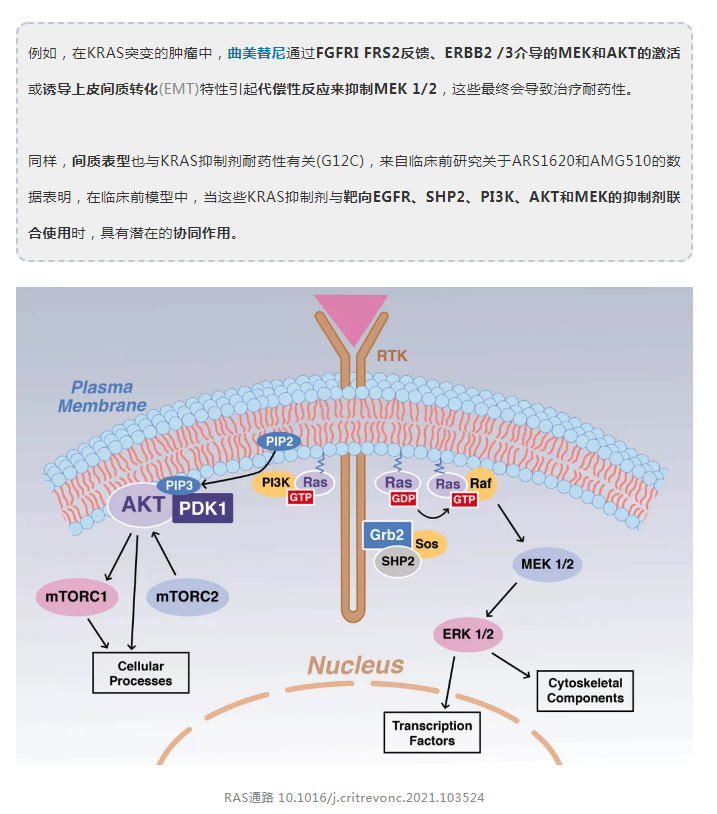
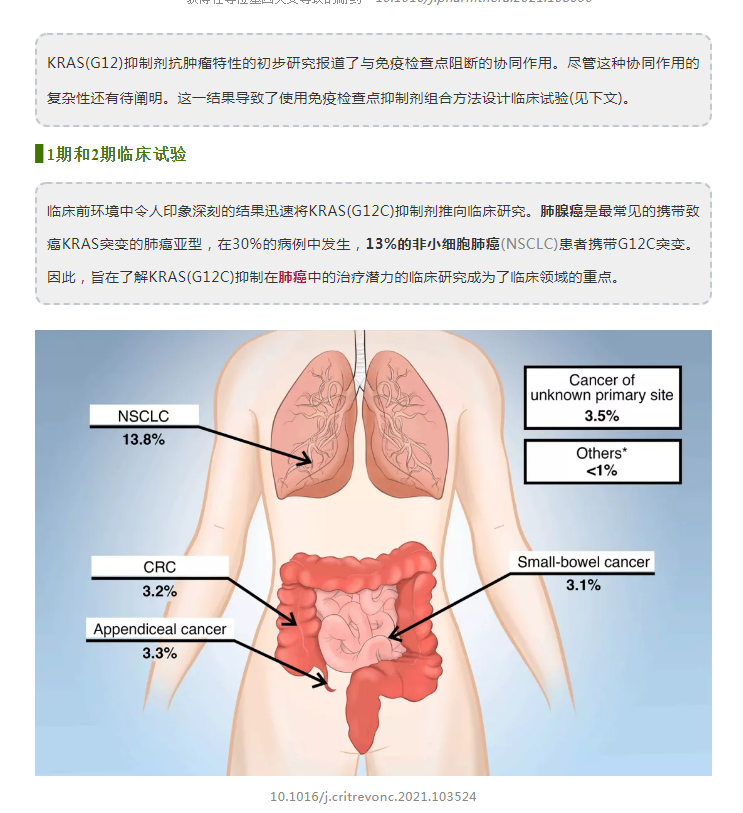
在含有KRASG12C突变的晚期实体肿瘤中的1期临床试验包括129例患者(其中59例为NSCLC)。在NSCLC亚组中,32.2%(19例患者)表现出客观缓解(完全或部分),疾病控制率为88.1%(52例患者)。中位缓解持续时间为10.9个月。所有NSCLC患者的中位无进展生存期为6.3个月。11.6%例患者出现3或4级治疗相关副反应。
在一项2期随访试验中,研究人员对之前治疗过的KRAS-2突变型晚期NSCLC患者口服Sotorasib(每日一次960 mg)的活性进行了研究。在纳入的126例患者中,81.0%曾接受过以铂为基础的全身化疗和免疫检查点抑制剂治疗。46例(37例)患者达到了客观观察效应,其中4例(3.2%)完全缓解,42例(33.9%)部分缓解。中位缓解持续时间为11.1个月。中位无进展生存期为6.8个月,中位总生存期为12.5个月。一项旨在了解治疗反应相关性的探索性生物标志物评估显示,50%的STKII突变和野生型KEAPI患者有临床疗效。在KEAPI突变的STKII和KEAPL的亚组中,有23%的患者出现了疗效;在STK11野生型和KEAPI突变的亚组中,有14%的患者出现了疗效。这些证据可能有助于指导和监测后续研究中携带这些突变的患者的治疗。更重要的是,该2期研究的阳性结果推动FDA于2021年5月批准Sotorasib用于KRAS(G12C)突变、局部晚期或转移性NSCLC等疾病当中。
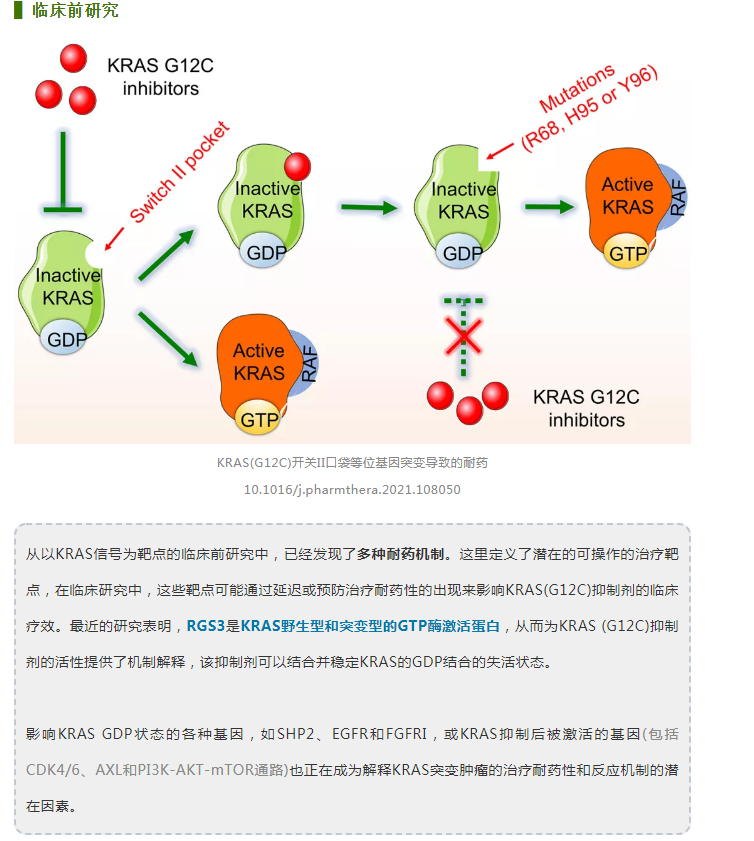
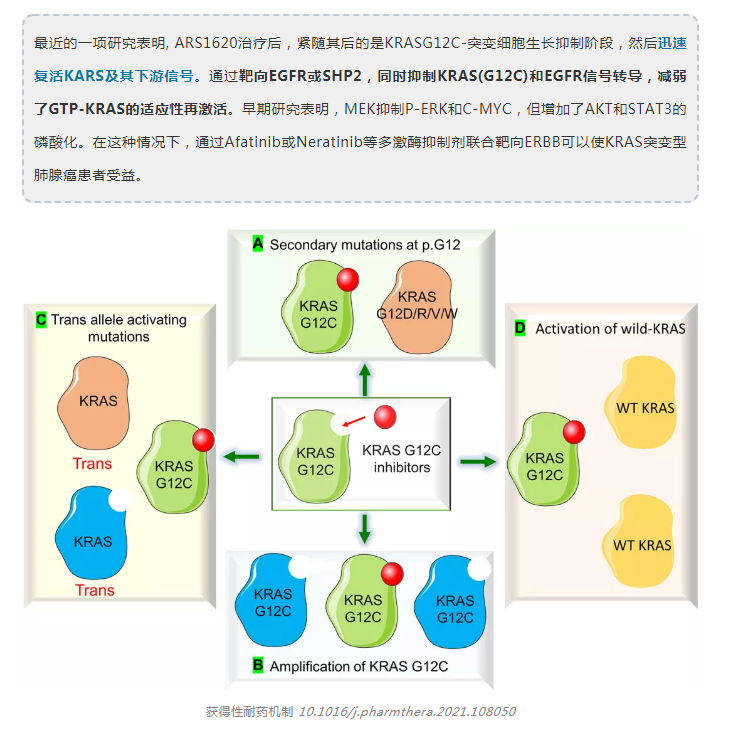
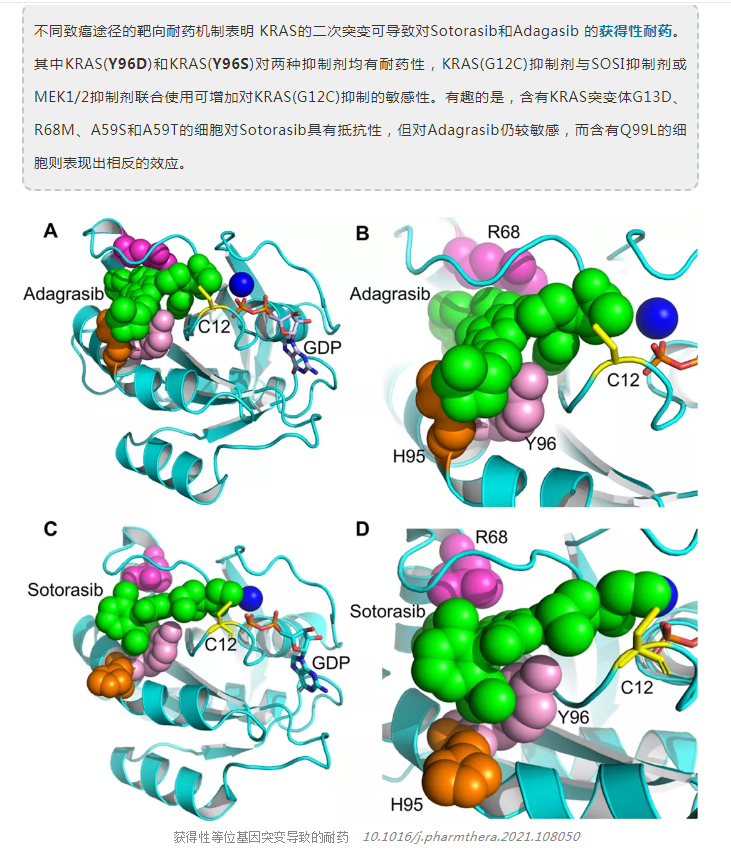
KRYSTAL试验中使用adgrasib单药治疗的G12C NSCLC患者,在疾病进展时获得的样本的基因组分析显示,获得的KRAS突变传递包括G12D/R/V/W、 G13D、QG1H、R68S、H95D/Q/R和Y96C以及KRASG12C等位基因的高水平扩增。其他潜在的旁路机制包括MET扩增、NRAS、BRAF、MAP2K1、RET、NFL和PTEN的突变。还发现涉及ALK、RET、BRAF、RAFI和FGFR3的致癌融合。有趣的是,融合癌蛋白,如ALK和RET形成无膜的细胞质蛋白颗粒,以非脂质膜的方式激活RAS信号,而SHP2和SOS1是受体酪氨酸激酶(RTK)信号的亚细胞平台的关键组成部分,表明可能的耐药性机制。其他潜在的旁路机制包括MET扩增和NRAS、BRAF MAP2K1、RET、 NFL和PTEN的突变。
一项多中心、随机、开放标签3期临床试验,研究对象为局部晚期、不可切除或转移性KRASG12C突变的NSCLC患者。在345名招募患者的队列中,本研究将比较AMG510和多西他赛的疗效,PFS作为主要结局,总生存质量、缓解持续时间和总缓解率等作为次要结局(Codebreak200/ NCT04303780)。
从2019年12月首次发布KRAS(G12C)抑制剂,到2021年6月FDA批准这些治疗药物,KRAS(G12C)抑制剂在理论和临床的治疗进展方面都是令人印象深刻的。在不同的环境和肿瘤类型下,是否会获得长期的反应,以及长期暴露可能会产生哪些不良事件,仍有待确定。鉴于这些抑制剂对KRAS(G12C)的靶向选择,针对其他的KRAS突变体的靶向治疗是一个持续的挑战,需要基础科研人员和临床医务人员的共同努力来突破这一难题。然而目前已有KRAS(G12C)靶向抑制的潜在证据,因此未来开发其他突变的KRAS抑制剂的前景似乎不在是一个可以难以实现的目标。
1. Zhang J, Zhang J, Liu Q, Fan XX, Leung EL, Yao XJ, Liu L. Resistance looms for KRAS G12C inhibitors and rational tackling strategies. Pharmacol Ther. 2022 Jan;229:108050. doi:10.1016/j.pharmthera.2021.108050. Epub 2021 Dec 3. PMID: 34864132.
2. Rosell, R., Aguilar, A., Pedraz, C. et al. KRAS inhibitors, approved. Nat Cancer 2, 1254–1256 (2021). https://doi.org/10.1038/s43018-021-00289-3